Винсент Тоули, VMD
Университет Пенсильвании, США
Доктор Тоули, получив ветеринарное образование, прошел чередующуюся интернатуру по лекарственной и хирургической терапии мелких животных в университете штата Пенсильвания. После этого он остался в университете и в настоящее время завершает ординатуру по неотложной медицине и реанимации. Его клинические интересы включают вопросы пульмонологии, электролитных и кислотно-щелочных нарушений, а также эндокринных расстройств.
Кеннет Дробац, DVM, MSCE, диплом ACVECC, диплом ACVIM
Университет Пенсильвании, США
Доктор Дробац окончил университет Калифорнии в Дэвисе. В течение двух лет после окончания университета работал в частной практике в южной Калифорнии, а затем прошел ординатуру по неотложной медицине и реанимации в университете штата Пенсильвания. После двух лет частной практики вернулся в университет, где сейчас занимает должность старшего преподавателя и руководит секцией по неотложной медицине и реанимации и Службой неотложной помощи. Он получил сертификаты специалиста по внутренним болезням, по неотложной медицине и реаниматологии.
Введение
Сердечно-легочная реанимация (СЛР) представляет собой ряд неотложных мероприятий по восстановлению и оптимизации перфузии головного мозга и сердца в период остановки сердца (ОС), с целью не только восстановить самостоятельное кровообращение (ВСК), но, что более важно, способствовать благоприятному неврологическому исходу. Хотя частота ОС у мелких животных неизвестна, выживаемость до выписки из стационара низкая, причем исходы более благоприятны, если остановка произошла под наркозом (1). В отличие от людей, у животных ОС часто сопровождается гипоксией и снижением оксигенации тканей, что может осложнить проведение реанимационных мероприятий, и чем может объясняться низкая выживаемость до выписки из стационара.
КЛЮЧЕВЫЕ МОМЕНТЫ
- Остановку сердца необходимо выявлять быстро, а для успешной сердечно-легочной реанимации важно провести основные реанимационные мероприятия, в том числе обеспечить проходимость дыхательных путей и начать вентиляцию легких и непрямой массаж сердца.
- После начала основных реанимационных мероприятий можно рассмотреть необходимость проводить дополнительные реанимационные мероприятия.
- Для оценки эффективности реанимационных мероприятий во время СЛР может быть полезно мониторировать концентрацию диоксида углерода в конце выдоха.
- В постреанимационном периоде часто развивается повторная остановка сердца, и выживаемость до выписки из стационара после остановки сердца в целом низкая; улучшить исходы можно, проводя терапию для оптимизации перфузии, оксигенации и вентиляции.
До недавнего времени принципы СЛР в ветеринарии в основном были заимствованы из литературы для человека, несмотря на некоторые заметные различия по физиологии и патофизиологии остановки сердца. Недавно опубликованы первые комплексные консенсусные руководящие принципы по СЛР у мелких животных, основанные на доказанных данных (2). В этой статье рассматриваются основные принципы СЛР, в том числе основные и дополнительные мероприятия при СЛР, а также вопросы постреанимационной помощи; их можно использовать для профилактики внезапной смерти у мелких животных.
Выявление ОС
Быстрое выявление ОС — важный этап для начала СЛР. Общие признаки надвигающейся остановки сердца включают прекращение самостоятельного дыхания, наличие агонального дыхания, острое ухудшение мышления, фиксацию и расширение зрачков, внезапное изменение частоты или ритма сердечных сокращений (3). Остановку следует
заподозрить у всех пациентов, не реагирующих на раздражители, при апноэ, а также при агональном характере дыхания. Проводить пальпацию пульса на периферических артериях или пытаться подтвердить ОС, проводя допплеровское исследование для оценки наличия сигнала не рекомендуется, так как это неизбежно затягивает начало проведения СЛР. Если пациент уже интубирован, острое снижение перфузии легких, например, вследствие ОС, можно предположить по резкому снижению содержания углекислого газа в конце выдоха (ЕТС02). Использовать в качестве единственного метода диагностики ОС электрокардиографию (ЭКГ) не следует, поскольку некоторые виды электрических ритмов при остановке сердца, особенно электромеханическая диссоциация (ЭМД), могут быть ошибочно приняты за ритм с сохранением кровообращения (4). При наличии сомнений следует как можно скорее начать СЛР, поскольку доказанных данных, свидетельствующих, что у пациентов, не переносящих ОС, основные реанимационные мероприятия могут причинять вред, очень немного.
У мелких животных наиболее распространенные виды ритма при ОС, выявляемые на ЭКГ, включают асистолию или ЭМД (3), хотя остановке сердца может предшествовать внезапное развитие брадиаритмии (рис. 1а). В «группе риска» полезен непрерывный мониторинг ЭКГ, который может позволить начать жизнесохраняющие мероприятия еще до появления необходимости в СЛР. Непрерывный мониторинг ЭКГ может также помочь выявить нарушения ритма сердца, которые наиболее эффективно лечат электрической дефибрилляцией, в том числе желудочковую тахикардию без пульса (ЖТ) и фибрилляцию желудочков (ФЖ )(рис. 1Ь)( 4).
Во время приема или до начала анестезии рекомендуется получить у владельца согласие на СЛР; врачу может быть полезно обсудить с клиентом потенциальную необходимость проводить СЛР (а также предположительно ожидаемые исходы) еще в начале консультации. Если затем обозначить соответствующим образом (например, с помощью цветовой системы) выбранный вариант поведения с пациентом, это гарантирует, что все члены бригады будут знать, какие следует предпринять меры при ОС (например, красный маркер — не реанимировать, желтый — только основные реанимационные мероприятия +/- назначение реанимационных препаратов; зеленый — дополнительные реанимационные мероприятия, в том числе открытый массаж сердца).

Рисунок 1. ЭКГ может помочь при выявлении ОС.
- Остановке сердца может предшествовать внезапное развитие брадиаритмии, например остановка синусового ритма с промежками желудочкового ритма на ЭКГ.
- Мониторинг ЭКГ может помочь определить сердечные аритмии, такие как фибрилляция желудочков, которые лучше всего лечить путем дефибрилляции.
Основные реанимационные мероприятия
Основные реанимационные мероприятия являются основой для успешного проведения СЛР, и в случае ОС врачу рекомендуется следовать системе «ABC» (airway, breathing, compressions — дыхательные пути, дыхание, непрямой массаж сердца) (3). Следует как можно скорее обеспечить проходимость дыхательных путей, проведя интубацию трахеи. В некоторых случаях интубация может быть осложнена наличием препятствий в верхних дыхательных путях. Рекомендуется держать под рукой эндотрахеальные трубки разных размеров, ларингоскопы, стилеты и отсос (табл. 1). Для лучшей визуализации гортани можно использовать ларингоскоп, причем можно попросить помощника держать рот пациента открытым и вытянуть язык. Если интубация из-за полной обструкции верхних дыхательных путей невозможна, необходимо чрескожно ввести в трахею катетер или провести срочную трахеостомию, чтобы обойти препятствия к вентиляции и оксигенации. Рассмотрение порядка проведения хирургической трахеостомии выходит за рамки настоящей статьи, и его можно найти в литературе (5).
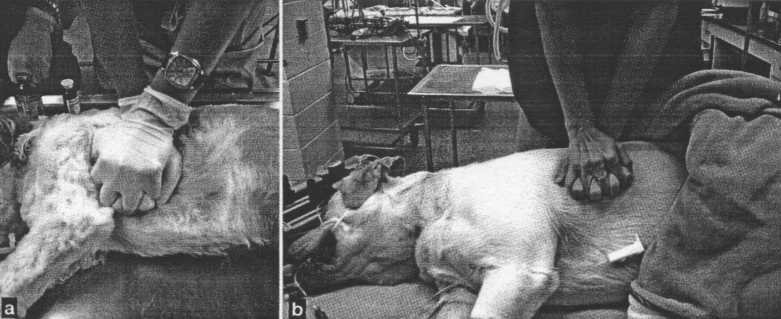
Рисунок 2. Закрытый массаж сердца при положении пациента лежа на боку. При процедуре у мелких животных врач располагает руки прямо I над сердцем в 5-м I межреберье (а).
У более крупных пациентов руки располагают над наиболее широкой частью грудной клетки (Ь).
Правильность размещения эндотрахеальной трубки можно подтвердить визуально, с помощью внутриротовой пальпации или пальпации трубки в трахее; врач может также выслушать дыхательные звуки через грудную стенку. Трубку следует закрепить на месте и раздуть манжету, чтобы предотвратить попадание жидкости или инородных частиц в дыхательные пути. По ЕТС02 оценить правильность интубации после ОС часто не удается, поскольку поступление двуокиси углерода в легкие может быть снижено из-за плохой перфузии. Тем не менее, высокие значения ЕТС02 подтверждают правильность интубации, поскольку содержание С02 в желудке или пищеводе низкое (4). Если возможно, интубацию предпочтительнее проводить в положении лежа на боку, так как это позволяет одновременно начать непрямой массаж сердца.
После обеспечения проходимости дыхательных путей начинают их вентиляцию 100% кислородом с частотой 10-12 вдохов/мин (6). Для этого можно использовать либо мешок Амбу, либо встроенный в анестезиологический аппарат предохранительный редукционный клапан. В мешки Амбу встроен предохранительный клапан для предотвращения баротравмы во время вентиляции; если используется анестезиологический аппарат, в конце вдоха давление должно быть <20 см Н20. Более высокое давление может потребоваться у пациентов с избыточным весом или низкой податливостью грудной клетки вследствие заболеваний легких, но чрезмерного давления следует избегать, так как оно может привести к травме легочной паренхимы или пневмотораксу. Основным фактором, определяющим тонус сосудов мозга и, следовательно, риск нарушения мозгового кровообращения, является парциальное давление углекислого газа в артериальной крови (7); следовательно, во время СЛР необходимо соблюдать осторожность, чтобы избежать как гипер-, так и гиповентиляции. Развивающаяся на фоне гипервентиляции гипокапния приводит к сужению сосудов, что может способствовать ишемии головного мозга (7). Чрезмерная вентиляция также может вызвать положительное внугригрудное давление, которое может затруднить венозный возврат крови к сердцу и уменьшить перфузионное давление в коронарных артериях (8). Если СЛР проводят несколько человек, может быть целесообразно выделить одного человека для обеспечения искусственного дыхания с частотой один вдох каждые 6 секунд.
Непрямой массаж сердца следует начать как можно скорее и лучше всего выполнять при положении пациента лежа на боку, а врача сверху пациента, причем для массажа сердца он будет использовать вес верхней части тела и проводить его выпрямленными руками; если проводить его силой трицепсов с циклическими сгибанием и разгибанием в локтевых суставах, врач быстро устает. У пациентов с массой тела < 15 кг врач располагает руки прямо над сердцем в 5-м межреберье и непосредственно сдавливает желудочки сердца, обеспечивая движение крови в магистральные артерии («сердечный насос») (рис. 2а).
Таблица 1. Состав укладки для неотложной помощи.
| Проходимость дыхательных путей/интубация |
| • Эндотрахеальные трубки (различных размеров, внутренним диаметром 2-12 мм)
• Ларингоскоп с функционирующей подсветкой и лезвиями (разных размеров) • Стилеты для эндотрахеальной трубки • Марлевые тампоны (для использования при вытягивании языка) • Марлевая повязка на морду (для фиксации эндотрахеальной трубки) • Шприц для воздуха или надувная манжета (для раздувания манжеты эндотрахеальной трубки) |
| Препараты для лечения остановки сердца и другие препараты |
| • Адреналин • Кальция глюконат
• Атропин • Глюкоза • Вазопрессин • Налоксон • Лидокаин • Флумазенил • Натрия бикарбонат • Атипамезол |
| Дефибрилляция |
| • Электроды дефибриллятора
• Переходник для заднего электрода (размещают под пациентом) • Контактный гель для дефибрилляции |
| Хирургическое оборудование |
| • Стерильные хирургические лезвия (для венесекции или других процедур)
• Малая хирургическая укладка (для открытого массажа сердца при СЛР) |
| Разное |
| • Катетеры для в/в вливаний и катетеры-бабочки (разных размеров)
• Катетеры и емкости для отсоса • Пластыри для ЭКГ • Лейкопластырь • Шприцы различных размеров • Трехходовой кран • Шовный материал |
У пациентов весом >15 кг руки располагают над наиболее широкой частью грудной клетки; непосредственно сжимают грудную клетку, повышая внутригрудное давление и благодаря этому — усиливая прямой поток крови («грудной насос») (рис. 2Ь). Г рудную клетку следует сжимать до примерно 1/3-1/2 от ее ширины; рекомендуется проводить компрессию с частотой 100-120/мин. Важно обеспечить полное упругое расправление грудной клетки после компрессии — отрицательное внутригрудное давление необходимо для возврата крови в крупные вены и в сердце (6). Получено ограниченное число доказанных данных, что может быть эффективна перемежающаяся компрессия брюшной полости, но это может привести к появлению обратного потока крови к сердцу (6).
Наружный непрямой массаж сердца может обеспечить сердечный выброс около 25% от нормального объема. Проводящего массаж человека необходимо каждые две минуты заменять, чтобы избежать его утомления (6), и в течение этой краткой паузы в ходе непрямого массажа сердца можно оценивать наличие самостоятельных сердечных сокращений или получать ЭКГ; в остальном прерывания массажа следует минимизировать, поскольку после паузы адекватная коронарная перфузия может восстанавливаться несколько минут (9).
Дополнительные реанимационные мероприятия
Дополнительные реанимационные мероприятия продолжают основные и предназначены для достижения ВСК. В идеале основные и дополнительные мероприятия проводят одновременно, но, если число проводящих реанимацию людей ограничено, важней всего обеспечить вентиляцию легких и качественный непрямой массаж сердца, а фармакологическую терапию начинают лишь после начала этих мероприятий.
Перфузионное давление в коронарных сосудах определяется диастолическим давлением в аорте и давлением в правом предсердии. Кроме того, важно церебральное перфузионное давление, представляющее собой разницу между средним артериальным давлением и внутричерепным давлением (10). При СЛР используют вазопрессорные препараты, увеличивающие периферическое сосудистое сопротивление, которое повышает давление в аорте; в сочетании с правильно выполняемыб/ непрямым массажем сердца это позволяет оптимизировать перфузию сосудов сердца и мозга.
Эпинефрин (адреналин) — смешанный агонист адренерги ческих рецепторов, действующий и на а-, и на (b-рецепторы Адреналин стимулирует (b-рецепторы в миокарде, увеличивая частоту сердечных сокращений, сократимость миокард; и потребность миокарда в кислороде. (b2-опосредованны( эффекты включают в себя релаксацию гладкой мускула туры сосудов и бронхов. Адреналин применяют при СЛР i первую очередь благодаря его влиянию на рецепторы со судов, вызывающему сужение периферических сосудов и улучшение перфузии сосудов головного мозга и сердца (11). В литературе обсуждают применение как низких, та и высоких доз, но получены некоторые данные, что высокие дозы адреналина могут вызывать вредные побочны эффекты, связанные с его адренергической активностью в том числе повышение потребности миокарда в кислород в условиях плохой перфузии и распространение сердечны аритмий. Современные рекомендации предусматриваю введение низких доз адреналина (0,01 мг/кг внугривенно каждые 3-5 мин (табл. 2) (12).
Аргинин-вазопрессин (антидиуретический гормон) являв’ ся эндогенным вазопрессорным пептидом, и при СЛР ег предложено применять в качестве альтернативы адреналину. Вазопрессин влияет на рецепторы гладких мышц сосудистой стенки, вызывая периферическую вазокострикцию на фоне сохранения коронарного и мозгового кровотока. Функция адренорецепторов может нарушать; при тяжелой ацидемии, наоборот, функция вазопрессина в условиях ацидемии; нарушается, а период полувыведения более длительны чем адреналина (11). Данные о применении вазопрессина при СЛР в ветеринарии смешанные и относятся главным образом к научным исследованиям; проведено одно рандомизированное проспективное клиническое исследование (13). В нем сравнивали назначение адреналина и вазопрессина у собак во время СЛР, и разницы по ВСК между двумя группами не выявили. Тем не менее, современные руководящие принципы предусматривают повторное введение вазопрессина (0,8 ЕД/кг внутривенно) каждые три-пять минут как дополнение или вместо адреналина (табл. 2) (12).
Таблица 2. Дозы препаратов и схема мощности дефибрилляции при неотложной помощи
| Масса тела (кг) | 2,5 | 5, | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | |
| Препарат | Доза | МЛ | МЛ | МЛ | МЛ | МЛ | МЛ | МЛ | МЛ | МЛ | МЛ | МЛ |
| Адреналин, низкие дозы (1 мг/мл) | 0,01 мг/кг в/в | 0,03 | 0,05 | 0,1 | 0,15 | 0,2 | 0,25 | 0,3 | 0,35 | 0,4 | 0,45 | 0,5 |
| Адреналин, высокие дозы (1 мг/мл)* | 0,1 мг/кг в/в | 0,25 | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 |
| Вазопрессин(20 ЕД/мл) | 0,8 ЕД/кг в/в | 0,1 | 0,2 | 0,4 | 0,6 | 0,8 | 1 | 1,2 | 1,4 | 1,6 | 1,8 | 2 |
| Атропин (0,54 мг/мл) | 0,04 мг/кг в/в | 0,2 | 0,5 | 0,8 | 1,1 | 1,5 | 1,9 | 2,2 | 2,6 | 3 | 3,3 | 3,7 |
| Лидокаин (20 мг/мл) | 2 мг/кг в/в (собаки) | 0,25 | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 |
| Налоксон (0,4 мг/мл) | 0,04 мг/кг в/в | 0,25 | 0,5 | 1 | 1,5 | 2 | 2,5 | 3 | 3,5 | 4 | 4,5 | 5 |
| Флумазенил (0,1 мг/мл) | 0,02 мг/кг в/в | 0,5 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Атипамезол (5 мг/мл) | 0,1 мг/кг в/в | 0,05 | 0,1 | 0,2 | 0,3 | 0,4 | 0,5 | 0,6 | 0,7 | 0,8 | 0,9 | 1 |
| Мощность разряда | J | J | J | J | J | J | J | J | J | J | J | |
| Дефибриллятор — наружный | 4-6 Дж/кг ** | 10 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| Дефибриллятор — внутренний | 0,2-0,4 Дж/кг ** | 1 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
* Высокие дозы адреналина следует использовать с большой осторожностью. ** Мощность разряда приведена для однофазного дефибриллятора (см. ссылку 15).
Атропина сульфат — это антимускариновый парасимпатолитический препарат, блокирующий действие афферентных импульсов блуждающего нерва на синоатриальный и атриовентрикулярный узлы в сердце, увеличивающий частоту синусового ритма пазухи и скорость проведения импульсов в сердце (14). Атропин (0,04 мг/кг), вводимый каждые 3-5 минут, считают препаратом выбора для реанимации животных с остановкой сердца, опосредованной активностью блуждающего нерва (табл. 2) (12). Ее можно заподозрить у животных в критическом состоянии с высоким тонусом блуждающего нерва в покое, особенно если на фоне брадикардии развиваются периодические срыгивания, рвота, кашель или затрудненные мочеиспускание/ дефекация. У этих больных целесообразно проводить постоянный мониторинг ЭКГ для выявления внезапного развития брадиаритмий, так как введение атропина при таких эпизодах может предотвратить развитие ОС.
Могут быть полезны также другие фармакологические средства, включая антагонисты анестетиков, лидокаин, бикарбонат натрия. Для купирования действия опиоидов можно ввести налоксон, флумазенил устраняет действие бензодиазепинов, атипамезол — а2-агонистов (табл. 2). При ЖТ с отсутствием пульса может быть наиболее целесообразно начать лечение с электрической дефибрилляции, но, если провести дефибрилляцию немедленно невозможно, вводят лидокаин (2 мг/кг у собак), антиаритмический препарат класса lb, блокирующий быстрые натриевые каналы. Учитывая повышенную восприимчивость к токсическому действию лидокаина, у кошек его следует использовать с осторожностью (0,2 мг/кг внутривенно). Бикарбонат натрия — буферный препарат, не рекомендуется использовать в обычной практике, однако при длительном течении ОС (>10-15 мин) он может быть использован (по 1 мг-экв/кг внутривенно) для лечения ацидоза (12).
Назначение препаратов в центральные вены рекомендуется, если катетер в яремной уже установлен, поскольку это позволяет обеспечить высокий уровень препарата в миокарде. Тем не менее, центральный венозный доступ может быть обеспечить трудно, и массаж сердца для установки катетера прерывать не следует. Если используется периферический катетер, препараты следует назначать со стерильным физиологическим раствором в объеме по меньшей мере 10-20 мл, чтобы облегчить их поступление в центральные сосуды. Некоторые лекарства, в том числе адреналин, вазопрессин и атропин, можно вводить через эндотрахеальную трубку. Препарат можно разбавить физиологическим раствором, его вводят через длинный катетер, проводимый вниз по трубке между вдохами, в этой ситуации адреналин следует вводить в высоких дозах. Выбор дозировки атропина и вазопрессин при внутритрахеальном введении неоднозначен, но многие врачи назначают дозу, вдвое превышающую обычную дозу для в/в введения.
Электрическая дефибрилляция является методом выбора при лечении определенных нарушений ритма сердца, которые могут отмечаться во время СЛР, а именно ЖТ и ФЖ с отсутствием пульса. Фибрилляция желудочков обусловлена случайной и несогласованной электрической активностью в желудочках сердца; при электрической дефибрилляции пытаются вызвать деполяризацию всего миокарда, при этом большинство клеток миокарда попадают в рефрактерный период, и за это время может возобновиться функция синусового узла, как водителя ритма сердца. Однофазные дефибрилляторы создают однонаправленный электрический ток от одного электрода к другому, в то время как двухфазные дефибрилляторы формируют ток между электродами в обоих направлениях (15). Последние предпочтительнее, поскольку позволяют уменьшить мощность дефибрилляции и вызывать меньшее повреждение миокарда. Необходим хороший контакт между телом пациента и электродами, поэтому перед использованием дефибриллятора следует нанести пасту для дефибриллятора или гель; при необходимости электроды можно прижать зажимом. Электроды следует с легким нажимом размещать по обе стороны грудной клетки над сердцем на уровне реберно-хрящевого сочленения. Для пациентов в положении лежа на боку задний электрод можно поместить под тело пациента, обеспечив прижатие электрода к нижней стороне тела (рис. 3). С другой стороны, при положении лежа на спине дефибрилляцию можно провести, расположив электроды по обе стороны грудной клетки; чтобы облегчить укладку, можно использовать V-образный лоток. Для наружной дефибрилляции рекомендуется начальная мощность разряда 4-6 Дж/кг для однофазных дефибрилляторов и 2-4 Дж/кг для двухфазных дефибрилляторов (15). Когда электроды заряжены, оператор должен убедиться, что тела пациента не касаются кто-либо из людей или какие-либо металлические предметы, в том числе стол, так как такой контакт может привести к серьезным травмам персонала. Если после разряда ВСК достигнуто не будет, в течение двух минут должен быть возобновлен непрямой массаж сердца, и после этого можно провести повторную ЭКГ для определения необходимости в дальнейших процедурах дефибрилляции. Если первый разряд неэффективен, предлагается увеличить мощность дефибрилляции на 50% (15). Если во время СЛР развивается ФЖ, а электрическая дефибрилляция недоступна, можно нанести удар по грудной клетке, хотя эффективность этого вмешательства невысокая.
В некоторых случаях может быть целесообразно провести открытую СЛР через боковой торакотомический доступ. У очень крупных пациентов обеспечить достаточный сердечный выброс, позволяющий восстановить кровоснабжение головного мозга и сердца, при наружном массаже сердца маловероятно. Наружный непрямой массаж сердца также может быть неэффективен на фоне высокого внутригрудного давления из-за скопления в плевральной полости жидкости, воздуха или тканей, или при перикардите. При травме грудной стенки с переломами ребер провести непрямой массаж сердца может оказаться невозможно, поскольку фрагменты ребер могут повреждать подлежащие ткани легких и сердца. У пациентов со значительным внутрибрюшным кровотечением, приведшим к ОС, открытая СЛР теоретически обеспечивает преимущество, поскольку позволяет закрыть просвет нисходящей аорты и предотвратить дальнейшее кровоизлияние, а также обеспечить преимущественное кровоснабжение сердца и головного мозга. Наконец, открытую СЛР предлагается проводить у всех пациентов, у которых длительный (> 10 минут) непрямой массаж сердца не обеспечил ВСК.
После решения о-проведении открытой СЛР выполняют боковую торакотомию, быстро пережав и асептически обработав грудную стенку в 5-м межреберье. Разрез проводят от задней части грудной стенки до реберно-хрящевого сочленения по краниальному краю ребра, подлежащие ткани рассекают острым лезвием до уровня плевры. Для входа в плевральную полость между вдохами, чтобы избежать повреждения легких, проводят тупую диссекцию тканей пальцем или кровоостанавливающим зажимом. Ребра отводят (вручную или механически) и начинают непосредственную компрессию сердца. При перикардите можно рассечь перикард в области грудинно-перикардиальной связки, стараясь не повредить диафрагмальный нерв. Вдоль спинной части грудной стенки можно определить нисходящую аорту, которую можно зажать пальцем, стерильной пуповинной лентой или дренажом Пенроуза (16). В случае необходимости можно провести открытую дефибрилляцию с начальной мощностью разряда 0,2-0,4 Дж/кг; перед ее началом между лопатками и сердцем следует проложить марлю, пропитанную стерильным физиологическим раствором. После успешной открытой СЛР нужно промыть грудную полость стерильной жидкостью и закрыть разрез, установив в плевральную полость дренажную трубку. Тем не менее, oi крытую СЛР следует начинать, только если легко доступно и есть возможность наладить в послеоперационном периоде круглосуточную интенсивную терапию.
Мониторинг во время СЛР
Из всех доступных устройств для мониторинга, вероятно наиболее полезным в ситуациях СЛР оказывается капнограф для определения содержания газов в конце выдоха. Как уже говорилось ранее, ЕТС02 часто исходно очень низкая или нулевая, поскольку перфузия легочной ткан снижена, а С02 в легкие не поступает. Увеличение ЕТСС во время СЛР предполагает, что непрямой массаж сердца обеспечил пропульсивный кровоток, причем величин ЕТС02 положительно коррелирует с коронарной перфузией. В каком-то смысле, капнография в конце выдоха позволяет в режиме реального времени оценивать сердечный выброс, а отсутствие увеличения ЕТС02 должно побудить врача заново оценить эффективность стратегии СЛР (У человека значения ЕТС02 >10 мм рт. ст. в течение первых 20 минут СЛР с высокими чувствительностью и специфичностью служат прогностическим показателем ВСК (Если мониторинг ЕТС02 недоступен, определить ВСК во время паузы в СЛР может помочь пальпация периферического пульса, аускультация сердечных тонов и оценка ЭКГ.
Ветеринарная помощь в постреанимационном периоде
У многих пациентов после достижения ВСК через несколько часов или дней после первого эпизода происходит повторная ОС (1). Часто развивается постреанимационный синдром, включающий высвобождение провоспалительных цитокинов, нарушение микроциркуляции, повышение проницаемости сосудов с потерей жидкости в интерстиции оглушенное состояние миокарда, приводящее к снижен его систолическое функции (18). Кроме того, может обостриться патология, приведшая к ОС. Успешная СЛР — только первый этап в обеспечении благоприятного исхода у этих пациентов, и в послереанимационном периоде, правило, требуются интенсивная терапия и мониторинг.
Оптимизацию гемодинамических показателей путем внутривенной инфузионной терапии, введение инотроповазопрессоров следует проводить целенаправленно, для снижения определенных конечных точек, включая нормализацию артериального давления и купирование лактоацидоза.
В послереанимационном периоде часто развиваются отек легких вследствие непрямого массажа сердца, отек легких, пневмония, и может потребоваться дополнительное назначение кислорода, скорость которого подбирают так, чтобы поддерживать насыщение гемоглобина кислородом (S| на уровне 94-98% (15). Гипероксии следует избегать, та» она может привести к генерации активных форм кислорода, которые могут повреждать ДНК, белки и клеточные и мембраны, что усиливает повреждение тканей (19,20). Следует контролировать уровень глюкозы в крови и поддерживать нормогликемию, в необходимых случаях вводя глюкозу или инсулин. Для лечения отека мозга вследствие длительной ишемии могут быть полезны гипертонический раствор или маннитол. Может развиваться связанная с критическими состояниями кортикостероидная недостаточность (CIRCI), при которой эффективно введение кортикостероидов в физиологических дозах, однако доказанных данных в поддержку обязательного использования более высоких доз глюкокортикоидов у больных после ОС не получено (21).
Остановка сердца на фоне анестезии
Остановка сердца на фоне анестезии рассматривается здесь отдельно, поскольку ее исходы часто более благоприятные, так как во многих случаях перед общим наркозом пациенту уже установлена эндотрахеапьная трубка, обеспечен венозный доступ и монитор сердечной деятельности. В одном исследовании с участием 204 пациентов, перенесших ОС, только 12 дожили до выписки из стационара, и 75% из этих пациентов находились во время ОС под наркозом (1). Полезным методом для мониторинга течения ОС у пациентов под наркозом является капнография в конце выдоха; внезапное снижение ЕГС02 может указывать на легочную гипоперфузию, появление которой можно ожидать при развитии ОС. Если данными аускультации подтверждается ОС, необходимо проверить, не перегнулась ли или не закупорена ли эндотрахеальная трубка, и убедиться, что запорный клапан
аппарата для анестезии не закрыт. Все емкости с летучими газообразными анестетиками должны быть отключены, и при необходимости назначены препараты для купирования эффекта анестезирующих средств. Если брюшная полость вскрыта для лапаротомии, доступ для проведения открытого массажа сердца можно обеспечить, проведя разрез через диафрагму. Во время анестезии полезно держать перед глазами четко различимую схему дозирования препаратов для неотложной помощи (табл. 2).
Заключение
У мелких животных ОС происходит нередко, и ее следует заподозрить во всех случаях отсутствия реакции на раздражители, апноэ или агонального типа дыхания. При подозрении на ОС следует быстро начать основные реанимационные мероприятия, включая обеспечение проходимости дыхательных путей для проведения оксигенации и искусственной вентиляции, а также правильно проводить непрямой массаж сердца. Введение препаратов для неотложной помощи и дефибрилляцию, если имеется соответствующий сердечный ритм, в идеале следует начать на ранних стадиях сердечно-легочной реанимации, но, если число врачей для реанимации ограничено, приоритетными являются искусственная вентиляция легких и непрямой массаж сердца. После успешной СЛ Р во многих случаях развивается повторная остановка сердца, и после реанимации для оптимизации исходов требуется проводить интенсивную терапию.
Литература
- Hofmeister EH, Brainard ВМ, Egger CM, et al. Prognostic indicators for dogs and cats with cardiopulmonary arrest treated by cardiopulmonary cerebral resuscitation at a university teaching hospital. J Am Vet Med Assoc 2009; 235:50-57.
- Boiler M, Fletcher DJ. RECOVER evidence and knowledge gap analysis on veterinary CPR. Part 1: Evidence analysis and consensus process: collaborative path toward small animal CPR guidelines. J Vet Emerg Crit Care 2012;22(S1):S4-12.
- Dhupa N. Cardiopulmonary Arrest and Resuscitation. In: Ettinger SJ, Feldman EC, eds. Textbook of Veterinary Internal Medicine: Diseases of the Dog and Cat, Vol 1. 6th ed. St. Louis: Elsevier Saunders, 2005:407-409.
- Brainard BM, Boiler M, Fletcher DJ, et al. RECOVER evidence and knowledge gap analysis on veterinary CPR. Part 5: Monitoring. J Vet Emerg Crit Care 2012;22(S1):S65-84.
- Fudge M. Tracheostomy. In: Silverstein DC, Hopper K, eds. Small Animal Critical Care Medicine. St. Louis: Elsevier Saunders, 2009:75-77.
- Hopper K, Epstein SE, Fletcher DJ, et al. RECOVER evidence and knowledge gap analysis on veterinary CPR. Part 3: Basic life support. J Vet Emerg Crit Care 2012;22(S1):S26-43.
- Ainslie PN, Duffin J. Integration of cerebrovascular C02 reactivity and chemoreflex control of breathing: mechanisms of regulation, measurement, and interpretation. Am J Physiol Regul Integ Comp Phys 2009:296:1473- 1495.
- Aufderheide TP, Sigurdsson G, Pirrallo RG, et al. Hyperventilation-induced hypotension during cardiopulmonary resuscitation. Circulation 2004;109:1960-1965.
- Steen S, Uao Q, Pierre L, et al. The critical importance of minimal delay between chest compressions and subsequent defibrillation: a haemodynamic explanation. Resuscitation 2003;58:249-253.
- Sunde K, Andreas P. The use of vasopressors agents during cardiopulmonary resuscitation. Crit Care Clinics 2012;28:189-198.
- Zhong J, Dorian P. Epinephrine and vasopressin during cardiopulmonary resuscitation. Resuscitation 2005;66:263-269.
- Rozanski EA, Rush JE, Buckley GJ, et al. RECOVER evidence and knowledge gap analysis on veterinary CPR. Part 4: Advanced life support. J Vet Emerg Crit Care 2012;22(S1):S44-64.
- Buckley GJ, Rozanski EA, Rush JE. Randomized, blinded comparison of epinephrine and vasopressin for treatment of naturally occurring cardiopulmonary arrest in dogs. J Vet Intern Med 2011 ;25:1334-1340.
- Management of Arrhythmias. In: Ware WA, ed. Cardiovascular Disease in Small Animal Medicine. 3rd ed. London: Manson Publishing Ltd, 2011:194- 226.
- Fletcher DJ, Boiler M, Brainard BM, et al. RECOVER evidence and knowledge gap analysis on veterinary CPR. Part 7: Clinical guidelines. J Vet Emerg Crit Care 2012:22(S1):S102-131.
- Cardiopulmonary-Cerebral Resuscitation (CPCR) In: Macintire DK, Drobatz KJ, Haskins SC and Saxon WD, eds. Manual of Small Animal Emergency and Critical Care Medicine. Baltimore: Lippincott Williams & Wilkins, 2005:16-26.
- Cantineau JP, Lambert Y, Merckx P, et al. End-tidal carbon dioxide during cardiopulmonary resuscitation in humans presenting mostly with asystole: A predictor of outcome. Crit Care Med 1996:24:791 -796.
- Adrie C, Adib-Conquy M, Laurent I, et al. Successful cardiopulmonary resuscitation after cardiac arrest as a “sepsis-like” syndrome. Circulation 2002;106:562-568.
- Kilgannon JH, Jones AE, Shapiro Nl, et al. Association between arterial hyperoxia following resuscitation from cardiac arrest and in-hospital mortality. J Am Med Assoc 2010:303:2165-2171.
- Balan IS, Fiskum G, Hazelton J, et al. Oximetry-guided reoxygenation improves neurological outcome after experimental cardiac arrest. Stroke 2006;37:3008-3013.
- Smarick SD, Haskins SC, Boiler M, et al. RECOVER evidence and knowledge gap analysis on veterinary CPR. Part 6: Post-cardiac arrest care. J Vet Emerg Care 2012;22(S1):S85-101.
