Д.М. Зубовский, Государственное учреждение «Белорусский государственный ветеринарный центр», главный ветеринарный врач
В статье анализируются возможности различных методов лабораторного исследования содержания микотоксинов в кормах для подтверждения диагноза на микотоксикоз. Приводится сравнительная стоимостная характеристика инструментальных и экспресс-методов.
Введение. Микотоксины – нелетучие, сравнительно низкомолекулярные «вторичные» продукты обмена веществ микроскопических грибов, которые могут воздействовать на людей и животных. Эти соединения считают «вторичными» метаболитами, так как они не являются необходимым компонентом для роста и развития грибов. Функции микотоксинов до сих пор четко не установлены, но они, как полагают, играют роль в устранении других микроорганизмов, конкурирующих за тот же самый питательный субстрат. Предполагается, что они также помогают паразитическим грибам проникать в ткани хозяина1. Количество токсинов необходимое для получения неблагоприятного эффекта для здоровья разнится в зависимости от вида микотоксина, а также от иммунного статуса каждого животного или человека.
Нормируемые в Республике Беларусь микотоксины продуцируются в основном грибами родов Aspergillus, Fusarium, Penicillium. Однако микотоксины выделяются и от многих других видов грибов при определенных условиях роста. Виды и количества продуцированных микотоксинов зависят от штамма гриба, условий роста, а также от наличия или отсутствия других микроорганизмов в той же среде обитания. Микотоксины накапливаются на спорах грибов, фрагментах клетки и субстратах (источники питания).
Присутствие токсинообразующих грибов на кормах или продуктах питания не должно автоматически связываться с контаминацией соответствующими микотоксинами, так как на этот процесс влияет множество факторов. И наоборот, видимое благополучие (т.е. отсутствие плесени на корме) совсем не гарантирует отсутствие его токсичности, так как грибы могли погибнуть при изменившихся условиях хранения, а большинство микотоксинов обладает повышенной стойкостью к условиям окружающей среды3.
Материалы и методы исследований. Были использованы нормативные документы Республики Беларусь, Европейского Союза, результаты личной работы авторов по определению содержания микотоксинов в кормах, а также литературные данные по этому вопросу [1-4].
Результаты исследований. Микотоксины – очень важные грибковые метаболиты, которые представляют потенциальную угрозу здоровью животного и человека. Термин микотоксины охватывает широкую группу соединений весьма отличающихся по своему химическому строению (рисунок 13), а, следовательно, по оказываемому токсическому действию. Опасность для человека и животных, представляемая микотоксинами постоянно переоценивается. Для некоторых микотоксинов уже установлены максимально допустимые уровни2,4. Необходимость четкого определения вида и концентрации микотоксина, содержащегося в том или ином корме обуславливается также возможной контаминацией их несколькими микотоксинами одновременно, что не позволяет четко поставить диагноз на микотоксикоз, основываясь только на клинической картине. Исследование проб кормов, проводимое нами с 2003 года подтвердило, что, как правило (?85-90% случаев), в одном образце присутствует сразу несколько видов микотоксинов. Особенно это касается токсинов, продуцируемых грибами рода Fusarium. Исходя из изложенного, можно сделать вывод, что есть потребность в аналитических методах исследования гарантирующих, что корма и продукты питания не содержат микотоксины выше допустимых пределов.
В настоящее время существует ряд приборных методов количественного определения микотоксинов в кормах и продуктах питания. Наиболее распространенными из них в настоящее время являются методики с использованием тонкослойной хроматографии (ТСХ, TLC), высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC), газовой хроматографии (ГХ, GC), масс-спектрометрии (МС, MS) и их сочетаний.
Тонкослойная хроматография является хроматографической методикой, применяемой для разделения, оценки чистоты и идентификации органических соединений. Она основана на применении пластин с нанесенной неподвижной фазой и подвижной фазы (растворитель). Идентификация анализируемого вещества проводится при одновременном внесении на пластину экстракта образца и стандартных растворов с известной концентрацией. Различные соединения в смеси продвигаются по пластине с различной скоростью вследствие различия в закономерностях их разделения между мобильной жидкой и неподвижной фазами (рисунок 2). На этом принципе основано разделение веществ в смеси экстракта. Флуоресцирующие вещества выявляют в УФ-свете, все остальные – с помощью специфических реагентов.

Дальнейшее развитие метод получил под названием высокоэффективной тонкослойной хроматографии (ВЭТСХ, HPTLC). Уменьшение толщины слоя неподвижной фазы (до 100 мкм) и величины частиц (до 5 мкм), привело к лучшему разделению веществ за более короткий период времени.
Методы ТСХ доступны почти для всех микотоксинов. Обнаружение и специфическая идентификация разработана для каждого отдельного микотоксина, используя молекулярные свойства или реакции трансформации веществ.

Главные недостатки тонкослойной хроматографии:
§ малая производительность;
§ большинство образцов нуждается в этапах экстракции и очистки для удаления потенциальных помех и матричных соединений перед анализом;
§ концентрация анализируемого вещества должна быть в диапазоне 0,01-0,1 %;
§ использование токсичных и летучих веществ в качестве растворителя.
Методы высокоэффективной жидкостной хроматографии (ВЭЖХ) в области исследования микотоксинов главным образом используются для заключительного отделения матричных соединений и обнаружения интересующего анализируемого вещества. В настоящее время методы ВЭЖХ широко распространены из-за их превосходящих характеристик и надежности по сравнению с тонкослойной хроматографией. Методы ВЭЖХ были разработаны для большинства основных микотоксинов в зерновых культурах и другой сельскохозяйственной продукции. Большинство методов надежны и стабильны.
Метод ВЭЖХ основан на разделении анализируемого экстракта в неподвижной фазе хроматографической колонки (рисунок 3) (для анализа микотоксинов чаще используются колонки С8 и С18) и дальнейшей их идентификации и количественном определении с помощью специальных детекторов. Наиболее распространенными детекторами для анализа микотоксинов в настоящее время являются ультрафиолетовый и флюоресцентный.
Пределы чувствительности методов ВЭЖХ с применением данных детекторов могут доходить до 1 мкг/кг образца.
В литературе сообщалось о разработке методов ВЭЖХ для одновременного анализа нескольких микотоксинов. Особенно успешно таким образом анализируются трихотеценовые микотоксины, в частности трихотецены.

На практике для исследования кормов и продуктов питания в полевых условиях, условиях производственных и испытательных лабораторий требуются методы, позволяющие количественно и быстро исследовать большое число образцов на наличие микотоксинов, по возможности с наименьшими затратами сил и финансовых средств.
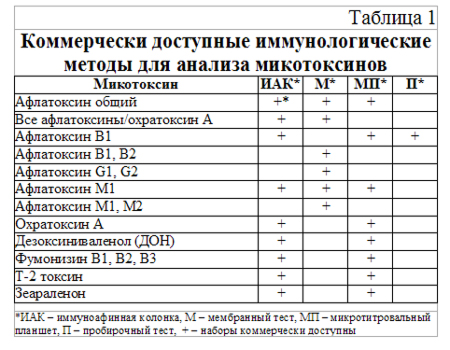
Всем этим характеристикам отвечают методы на основе иммунологических реакций. Коммерчески доступные иммунологические методы для анализа микотоксинов базируются на применении специфических моноклональных и поликлональных антител против определенных токсинов, и в целом делятся на:
§ метод на основе иммуноафинных колонок (ИАК, IAC);
§ иммуноферментный анализ (ИФА, ELISA) (таблица 1).
Обычно, иммуноафинные колонки фактически используются для очистки образца от матричных соединений и позволяют провести выделение и концентрирование определенного микотоксина.
Следующая за этим элюция токсина из ИАК позволяет провести количественное определение с использованием классических аналитических методов. В случае проведения иммуноферментного анализа, процедуры очистки обычно не столь интенсивны как при других аналитических методах. Гомогенат или экстракт образца, содержащий микотоксин, или непосредственно исследуется количественно, используя стандартный микротитровальный планшет или пробирочный анализ формата ИФА, или используется иммуноферментный мембранный тест для проведения качественного или полуколичественного определения наличия микотоксинов.
Другие методы по исследованию микотоксинов, использующие иммунологический подход, о которых сообщается в литературе, включают оптические и акустические биосенсоры, капиллярный электрофорез.
Образец, содержащий микотоксин, льют по иммуноафинной матрице Образец с микотоксином фильтруется через матрицу и микотоксин связывается на шариках Элюирующий буфер льют по матрице, и очищенный микотоксин вымывается в кювету для проб.

Иммуноафинные колонки обычно используются для очистки исследуемого образца от сложных матриц и концентрации токсинов перед обнаружением и оценкой содержания микотоксина, используя ряд классических аналитических методов, таких как ВЭЖХ, газовая хроматография, масс-спектрометрия, флуорометрия, ВЭТСХ и ТСХ. Метод заключается во введении экстракта образца в колонку, содержащую иммуноафинную матрицу, содержащую твердую фазу (например, гранулы агарозы), к которой ковалентно присоединены антитела против микотоксина (рисунок 4). Молекула токсина, содержащаяся в образце, присоединяется к соответствующему иммобилизированному антителу. Последующие шаги включают удаление несвязанных матричных компонентов и экстрагента, элюцию токсина, изменяя элюирующий состав и, наконец, обнаружение токсина, используя аналитические методы. Как альтернатива, микотоксин, связанный в колонке, может быть элюирован и непосредственно измерен флюорометрией, основанной на собственной флюоресценции микотоксинов.
Мембранный тест позволяет за короткий период времени (около 10-15 мин) дать ответ на вопрос: присутствуют ли в испытуемом образце микотоксины выше уровня предела чувствительности данного теста? То есть фактически это качественное определение наличия/отсутствия микотоксинов в пробе. Метод требует экстракции, фильтрации, очистки (через колонку) и разведения образца. Далее раствор наносится на мембрану сенсибилизированную моноклональными антителами, куда также добавляется ферментный конъюгат микотоксина. Если концентрация микотоксинов в образце превышает предел чувствительности теста, все антитела на поверхности связываются с ними и весь добавленный конъюгат удаляется на этапе отмывки. При добавлении бесцветного субстрата конъюгат на поверхности мембраны катализирует цветную реакцию, в результате которой на месте связывания конъюгата образуется цветное пятно. Окрашивание аналитической зоны мембраны говорит об отсутствии микотоксинов в образце.
Иммуноферментный анализ обычно используется для мониторинга наличия микотоксинов выше определенного уровня (или их отсутствия) в испытуемом образце. В настоящее время доступен ряд качественных, полуколичественных и количественных методов. Основываясь на результатах ИФА подозрительные образцы должны быть перепроверены классическими методами. Доступны различные варианты ИФА для анализа микотоксинов (например, мембранные тесты, микротитровальные планшеты и пробирочные методы). Как правило, метод ИФА основан на конкурентом анализе, который использует или связанные с ферментным конъюгатом микотоксины, или антитела против определенного анализируемого токсина (рисунок 5). Типичная последовательность реакций, используя готовые реактивы в формате микротитровального планшета следующие:
1. ферментный конъюгат добавляется к экстракту испытуемого образца;
2. смесь добавляется к соответствующим антителам, нанесенным на поверхность лунок планшета (например, микротитровальный планшет, сенсибилизированный антителами);
3. количество соединенного с токсином конъюгата, связываемое иммобилизированными антителами зависит от количества токсина в образце; чем выше количество токсина в образце, тем ниже будет количество ферментного конъюгата присоединившегося к антителам, нанесенным на поверхность лунок планшета и наоборот;
4. ферментативная активность связанного с поверхностными антителами конъюгата определяется добавлением соответствующего субстрата, что приводит к образованию окрашенных продуктов, концентрация которых обратно пропорциональна концентрации токсина в испытуемом образце.

На базе Белорусского государственного ветеринарного центра нами в течение 2004-2006 г.г. проводился анализ содержания микотоксинов в кормах с использованием иммуноферментного метода. Для исследования применялись готовые тест-системы производства компании R-Biopharm, Германия. Этой компанией выпускается ряд наборов для количественного определения микотоксинов: афлатоксины В, G, М, зеараленон, охратоксин А, Т-2 токсин, дезоксиниваленол, фумонизин В1, цитринина. Следует отметить, что практически для всех перечисленных микотоксинов существуют варианты тест-систем для определения особо малых концентраций этих токсичных соединений с пределом чувствительности на уровне хроматографических методик (RIDASCREEN® Mycotoxins) (время инкубации 1-2 часа) и экспресс-методы, позволяющие определять практически такие же концентрации в течение 15-30 минут (RIDASCREEN® FAST Mycotoxins). Все методики прошли утверждение в Республике Беларусь и могут использоваться в лабораториях, входящих в структуру Министерства сельского хозяйства и продовольствия.
Организация анализа микотоксинов в кормах и пищевых продуктах иммуноферментным методом возможна минимальными средствами и в самые короткие сроки. Простота эксплуатации и незначительная стоимость необходимого оборудования выгодно отличают иммуноферментный метод от классических методов анализа (таблицы 2, 3) и делают его особенно привлекательным для лабораторий с ограниченными финансовыми возможностями.
Необходимо отметить, что при практически равных показателях пределов обнаружения методы иммуноферментного анализа являются более производительными и позволяют проводить избирательное исследование только подозрительных по ИФА образцов инструментальными методами. Например, методом ИФА один лаборант может провести исследование 10-100 образцов за одну рабочую смену, в то время как при использовании ВЭЖХ – только 1-10 проб. При этом на проведение иммуноферментного анализа затрачивается от 15 минут до 3 часов (пробоподготовка до 1 часа), а методом ВЭЖХ – 2-4 часа при 1-3-дневной пробоподготовке.

 Выводы. Проведение исследований по выявлению загрязнения кормов микотоксинами за этот период позволило диагностировать внезапно возникшие вспышки заболеваний в нескольких хозяйствах республики, что дало возможность применить адекватные меры и тем самым снизить экономические потери производителей.
Выводы. Проведение исследований по выявлению загрязнения кормов микотоксинами за этот период позволило диагностировать внезапно возникшие вспышки заболеваний в нескольких хозяйствах республики, что дало возможность применить адекватные меры и тем самым снизить экономические потери производителей.
Затраты на своевременное исследование кормов собственного производства, а тем более закупаемых в других странах, всегда окажутся ниже, чем затраты на проведение экстренной диагностики вспыхнувшего заболевания, принятие необходимых мер по использованию или утилизации загрязненных кормов, а также потери от снижения продуктивности и гибели животных.
Литература:
1. Bioaerosols: Assessment and Control, 24.1.3. – ACGIH, Cincinnati, OH 1999.
2. Ветеринарно-санитарные нормы по безопасности кормов и кормовых добавок: : №48: утв. М-вом сельского хозяйства и продовольствия РБ от 28.04.08: ввод. в действие 28.04.08.
3. Европейская информационная сеть по микотоксикологии. – http://www.mycotoxins.org
4. Постановление Комиссии ЕС № 466/2001 от 8 марта 2001 года «Устанавливающая максимально допустимые уровни определенных контаминантов в продуктах питания». – OJ L 77, 16.3.2001. – p. 1.
